Reference :
- Biochemistry, 2nd Edition. Roger Miesfeld & Megan McEvoy w.w. Norton & Company (2021)
- 건국대학교 생화학 강의 / 시스템생명공학과 정선호 교수님
[CH1]
✅ 2번
Q. What types of molecules are enzymes? Name three physiologic processes that involve enzymes.
A. Most enzymes are proteins, though sometimes they are RNA molecules. Enzymes catalyze reactions in respiration, fermentation, nitrogen metabolism, energy conversion, and programmed cell death.
📘 한글 번역:
효소는 어떤 종류의 분자인가요? 효소가 관여하는 생리학적 과정 세 가지를 말해보세요.
정답: 대부분의 효소는 단백질이며, 가끔 RNA일 수도 있습니다. 효소는 호흡, 발효, 질소 대사, 에너지 전환, 세포 자멸 등에서 반응을 촉매합니다.
🧠 쉬운 풀이:
효소는 대부분 단백질이에요. 이들은 몸속에서 화학 반응을 빠르게 만드는 촉매 역할을 하죠. 예를 들면 우리가 숨 쉬고, 음식을 분해하고, 세포가 스스로 죽는 데까지 모두 효소가 필요해요!
✅ 9번
Q. What is base stacking and how does it contribute to the stability of the DNA helix? What other factor helps to stabilize this helix?
A. Base stacking involves noncovalent aromatic ring interactions between adjacent nitrogenous bases of the DNA helix. Hydrogen bonding between complementary base pairs also stabilizes the DNA helix.
📘 한글 번역:
염기적층(base stacking)이란 무엇이며, DNA 나선의 안정성에 어떻게 기여하나요? 또 다른 안정화 요인은 무엇인가요?
정답: 염기적층은 DNA의 질소 염기들 간의 비공유 결합 방향족 고리 상호작용을 의미합니다. 상보적인 염기쌍 간의 수소결합도 DNA 나선을 안정화시킵니다.
🧠 쉬운 풀이:
DNA는 계단처럼 생겼는데, 그 계단들이 서로 밀착하며 쌓여 있어요. 이게 바로 염기적층이에요. 이 덕분에 DNA는 쉽게 풀리지 않아요. 수소결합도 그걸 도와주죠!
✅ 10번
Q. Identify three types of RNA and describe their functions.
A. Messenger RNA is the template for protein synthesis. Small nuclear RNA has a role in RNA processing. Micro RNA regulates translation. Ribosomal RNA is a component of ribosomes. Transfer RNA provides amino acids to the ribosome for translation.
📘 한글 번역:
세 가지 종류의 RNA를 말하고, 그 기능을 설명하세요.
정답:
- mRNA: 단백질 합성의 설계도 역할
- snRNA: RNA 가공에 관여
- miRNA: 번역을 조절
- rRNA: 리보솜 구성 성분
- tRNA: 아미노산을 리보솜으로 운반
🧠 쉬운 풀이:
RNA에는 여러 종류가 있어요.
- mRNA는 단백질을 만들기 위한 설계도고,
- tRNA는 재료인 아미노산을 운반하고,
- rRNA는 단백질을 실제로 만드는 공장인 리보솜의 일부분이에요.
이 외에도 조절 역할을 하는 RNA들도 있어요!
✅ 14번
Q. Describe three things that Buchner did differently from Pasteur that are thought to have contributed to his success.
A. (1) Used a different strain of yeast; (2) prepared the yeast extract using quartz mixed with diatomaceous earth rather than using glass; (3) his extract buffer contained glucose, the carbon source for fermentation.
📘 한글 번역:
부흐너가 파스퇴르와 다르게 했던 세 가지 실험 방법은 무엇이며, 이것들이 그의 성공에 어떻게 기여했나요?
정답:
- 다른 종류의 효모 사용
- 효모 추출 시 유리 대신 규조토와 석영 사용
- 추출액에 발효를 위한 포도당 포함
🧠 쉬운 풀이:
부흐너는 효모 추출 실험을 할 때 파스퇴르와는 다르게 했어요.
예를 들어 효모 종류를 바꾸고, 유리 대신 다른 재료를 쓰고, 포도당까지 넣었죠. 이런 꼼꼼한 준비 덕분에 발효 성공!
✅ 18번
Q. Calculate the total number of possible dodecanucleotides that can be synthesized using the four nucleotides found in RNA.
A. 412=16,777,2164^{12} = 16,777,216
📘 한글 번역:
RNA에 존재하는 네 가지 뉴클레오타이드를 사용해 만들 수 있는 12개짜리 뉴클레오타이드 서열의 총 가짓수를 계산하세요.
정답: 412=16,777,2164^{12} = 16,777,216
🧠 쉬운 풀이:
RNA에는 A, U, G, C 네 가지 염기가 있어요. 각 자리에 4가지 선택이 가능한데, 12자리면 4^12 = 16,777,216가지 조합이 나올 수 있어요!
✅ 19번
Q. Explain why amylose and cellulose, both polymers of glucose, are not of equal nutritional value to humans.
A. Amylose is a glucose polymer with (α1→4) glycosidic bonds that can be cleaved by human enzyme amylase. Cellulose is a glucose polymer with (β1→4) glycosidic bonds that cannot be cleaved by human enzymes, but can be cleaved by microbial enzymes in horses.
📘 한글 번역:
둘 다 포도당으로 구성된 고분자인 아밀로스와 셀룰로오스가 사람에게 서로 다른 영양 가치를 가지는 이유는 무엇인가요?
정답: 아밀로스는 사람이 가진 아밀레이스라는 효소로 분해 가능하지만, 셀룰로오스는 β결합이라 사람은 분해하지 못하고, 말은 장내 미생물이 분해할 수 있습니다.
🧠 쉬운 풀이:
아밀로스는 우리가 분해해서 에너지로 쓸 수 있지만, 셀룰로오스는 우리 몸이 못 분해해요. 그래서 영양가가 없죠. 말은 특별한 미생물이 도와줘서 셀룰로오스도 먹을 수 있어요!
✅ 21번
Q. What is the sequence of the corresponding mRNA strand for the DNA coding strand 5′-AAA AAA TTT AAA TTT-3′?
A. mRNA: 5′-AAA AAA UUU AAA UUU-3′
Protein: NH₂–Lys–Lys–Phe–Lys–Phe–COO⁻
📘 한글 번역:
DNA 서열 5′-AAA AAA TTT AAA TTT-3′의 상보적인 mRNA 서열과, 해당 단백질 아미노산 서열은 무엇인가요?
정답:
mRNA: 5′-AAA AAA UUU AAA UUU-3′
단백질: Lys–Lys–Phe–Lys–Phe
🧠 쉬운 풀이:
DNA에서 mRNA로 전사할 때, T는 U로 바뀌어요. 그걸 아미노산으로 번역하면 AAA → Lys, UUU → Phe. 그래서 단백질은 Lys–Lys–Phe–Lys–Phe가 돼요!
✅ 24번
Q. What could you predict about the structure and function of two proteins that were less than 20% identical in their amino acid sequences? What could you predict about the structure and function of two proteins that were greater than 80% identical?
A. Less than 20% identity: proteins could have similar or different structures/functions.
Greater than 80% identity: likely to have same structure and function.
📘 한글 번역:
두 단백질의 아미노산 서열이 20% 미만으로 동일하다면, 구조와 기능에 대해 무엇을 예측할 수 있을까요? 80% 이상 동일하다면요?
정답:
- 20% 미만일 경우: 구조와 기능이 비슷할 수도, 다를 수도 있음
- 80% 이상일 경우: 구조와 기능이 같을 가능성이 높음
🧠 쉬운 풀이:
단백질 서열이 거의 같으면 구조랑 기능도 거의 같을 거예요. 근데 서열이 너무 다르면, 구조도 기능도 다를 수 있어요. 물론 가끔 예외도 있지만요!
[CH2]
✅ 3번
Q (영문):
What is the process by which ATP is formed by a phosphorylation reaction using energy released from the redox reactions in photosynthesis, and why is this important?
A (정답):
Photophosphorylation; it converts light energy into chemical energy in the form of ATP, which is essential for the production of glucose and other molecules in plants.
📘 한국어 해석:
광인산화(photophosphorylation)는 광합성 중 산화환원 반응에서 방출된 에너지를 사용하여 ATP를 만드는 과정이다. 이는 식물이 포도당과 다양한 분자를 만드는 데 필요한 화학 에너지(ATP)를 제공하기 때문에 중요하다.
🧠 쉬운 풀이:
햇빛 에너지를 받아서 ATP를 만든다고 생각하면 돼요. 마치 태양 전기를 배터리에 저장하는 것처럼, 식물은 빛 에너지를 ATP라는 "에너지 화폐"로 바꾸는 거예요.
✅ 4번
Q (영문):
Write out the equation for the change in Gibbs free energy. Briefly describe the meaning of this equation.
A (정답):
ΔG = ΔH - TΔS.
ΔG is the change in free energy, ΔH is the change in enthalpy (heat content), T is temperature in Kelvin, and ΔS is the change in entropy (disorder).
📘 한국어 해석:
깁스 자유 에너지 변화식: ΔG = ΔH - TΔS
ΔG: 자유 에너지 변화, ΔH: 엔탈피(열), T: 온도, ΔS: 엔트로피(무질서도) 변화
🧠 쉬운 풀이:
이 식은 "이 반응이 자발적으로 일어날까?"를 알려줘요. ΔG가 음수면 자발적으로 일어나고, 양수면 안 일어나요. 열(ΔH)과 무질서(ΔS)가 어떻게 작용하는지를 보여주는 공식이죠.
✅ 5번
Q (영문):
How can reactions that are unfavorable (endergonic) under standard conditions occur in living cells?
A (정답):
By coupling with favorable (exergonic) reactions, such as ATP hydrolysis.
📘 한국어 해석:
표준 조건에서는 자발적이지 않은 (엔더고닉) 반응도 ATP 가수분해 같은 자발적인 (엑서고닉) 반응과 연결(coupling)시켜 일어날 수 있다.
🧠 쉬운 풀이:
힘든 일을 혼자 못할 때 친구 도움 받아서 해내는 것처럼, 에너지가 필요한 반응은 에너지를 내는 반응(예: ATP 분해)이랑 붙어서 같이 일어나요!
✅ 7번
Q (영문):
Name and briefly describe the four basic types of weak interactions encountered in biochemistry.
A (정답):
- Hydrogen bonds – attraction between a hydrogen and an electronegative atom (like O or N)
- Ionic interactions – attraction between charged atoms
- van der Waals interactions – weak, short-range forces between nonpolar atoms
- Hydrophobic effect – nonpolar molecules group together to avoid water
📘 한국어 해석:
- 수소 결합: 수소와 전기음성 원자(O, N 등) 사이의 끌림
- 이온 상호작용: 전하를 가진 원자들 사이의 인력
- 반데르발스 상호작용: 비극성 원자 사이의 약한 힘
- 소수성 효과: 물을 피하려고 비극성 분자끼리 모이는 현상
🧠 쉬운 풀이:
이 네 가지는 분자들이 서로 "살짝" 붙는 방식이에요. 강하지는 않지만, 여러 개가 모이면 생명체 구조를 안정하게 만들 수 있어요.
✅ 10번
Q (영문):
What does it mean for a molecule to be amphipathic? Why are amphipathic lipids important for life?
A (정답):
An amphipathic molecule has both hydrophilic (water-loving) and hydrophobic (water-fearing) parts. They are important because they form biological membranes.
📘 한국어 해석:
양친매성 분자는 친수성 부분과 소수성 부분을 둘 다 가진 분자다. 이런 분자들은 세포막을 형성하는 데 필수적이다.
🧠 쉬운 풀이:
한쪽은 물 좋아하고, 한쪽은 물 싫어하는 분자예요. 이 성질 덕분에 세포막이 두 겹으로 잘 정렬되어 생명체를 보호하는 '막' 역할을 하게 돼요.
✅ 15번
Q (영문):
The change in free energy between reactants and products can be used to determine whether a reaction is spontaneous.
a. What is meant by the free energy terms ΔG°′ and ΔG?
b. Write an equation that describes ΔG°′ when a reaction is at equilibrium.
A (정답):
a. ΔG°′ is the standard free energy change under standard conditions. ΔG is the actual free energy change under cellular conditions.
b. ΔG°′ = -RT ln K_eq
📘 한국어 해석:
a. ΔG°′는 표준 상태에서의 자유 에너지 변화, ΔG는 실제 세포 내 조건에서의 자유 에너지 변화
b. ΔG°′ = -RT ln K_eq (K_eq는 평형 상수)
🧠 쉬운 풀이:
ΔG°′는 "실험실 조건", ΔG는 "진짜 세포 안 조건"이에요. 평형일 때 이 둘의 관계는 위 식으로 연결돼요.
✅ 16번
Q (영문):
The equilibrium constant K_eq for the reaction A ⇌ B is 1 × 10⁵ at 25°C.
a. If you started with a solution containing 1.000 M of A and 1 mM of B and let the reaction proceed to equilibrium, what would be the equilibrium concentrations of A and B?
b. Calculate ΔG°′ for this reaction.
A (정답):
a. [B] = 1.00099 M, [A] = 0.00001 M (계산 과정 있음)
b. ΔG°′ = -RT ln K_eq = -28.5 kJ/mol
📘 한국어 해석:
a. 평형 시 농도: A = 0.00001 M, B = 1.00099 M
b. ΔG°′ = -28.5 kJ/mol
🧠 쉬운 풀이:
반응이 거의 완전히 B 쪽으로 간다고 보면 돼요 (K_eq가 매우 크니까). ΔG°′가 음수니까 매우 자발적인 반응!
✅ 17번
Q (영문):
Given 5 hypothetical reactions with their ΔG°′ values,
a. Is it possible to write two pathways to form metabolite F from A?
b. Which pathway is more likely based on ΔG°′?
A (정답):
a.
- Pathway 1: A → B → E → F
- Pathway 2: A → D → F
b. Pathway 1 is more favorable (ΔG°′ = -4 kJ/mol)
📘 한국어 해석:
a. 두 경로 가능:
- 경로 1: A → B → E → F
- 경로 2: A → D → F
b. 경로 1이 더 자발적 (ΔG°′ = -4 kJ/mol)
🧠 쉬운 풀이:
총 ΔG가 음수인 쪽이 더 쉽게 일어나요. 첫 번째 경로는 ΔG 합이 음수니까 세포에서 더 자주 일어나는 경로겠죠!
✅ 22번
Q (영문):
Explain how energy charge affects metabolic flux through anabolic and catabolic pathways.
A (정답):
High energy charge activates anabolic pathways and inhibits catabolic ones. Low energy charge does the opposite.
📘 한국어 해석:
에너지 충전 상태가 높으면 동화작용이 활성화되고, 이화작용은 억제된다. 반대로 에너지 충전이 낮으면 이화작용이 촉진된다.
🧠 쉬운 풀이:
세포가 에너지가 많으면 "저장" 쪽으로 (동화), 에너지가 부족하면 "분해" 쪽으로 (이화) 활동해요. 배터리 충전량에 따라 전략이 바뀌는 거죠!
✅ 24번
Q (영문):
The water molecules hydrogen bond into a cage-like structure around the hydrophobic: limonene, increasing the order of the water molecules. This is entropically unfavorable, so ΔS is negative.
A (정답):
This describes the hydrophobic effect. Water becomes more ordered around nonpolar substances, decreasing entropy (ΔS < 0).
📘 한국어 해석:
소수성 물질 주변에서 물 분자들이 정렬되어 '우리'처럼 둘러싸는데, 이는 엔트로피가 감소(ΔS < 0)하는 비자발적인 현상이다.
🧠 쉬운 풀이:
기름(소수성 물질)을 물에 넣으면 물이 주변을 꽉 감싸요. 정렬된 상태는 무질서도가 줄어서 세포 입장에선 별로 안 좋아요.
✅ 34번
Q (영문):
The pKa for a typical long-chain fatty acid is ~5. Explain why long-chain fatty acids can form micelles in solutions with pH > 7 but are insoluble in solutions with pH < 5.
A (정답):
At pH > pKa, the carboxyl group is deprotonated (COO⁻), making the molecule amphipathic and able to form micelles. At pH < pKa, the molecule is not charged and cannot form micelles.
📘 한국어 해석:
pH > pKa에서는 지방산의 카복실기가 COO⁻ 형태가 되어 양친매성이 생기고 미셀 형성이 가능하다. pH < pKa에서는 미셀이 잘 안 생긴다.
🧠 쉬운 풀이:
pH가 높으면 지방산이 물과 기름 둘 다 좋아하는 성질이 생겨서 미셀(세포막 같은 구조)을 만들 수 있어요. 하지만 pH가 낮으면 그냥 기름처럼 돼서 물에 안 섞여요.
[CH3]
✅ 1. What is the difference between a nucleoside and a nucleotide?
A nucleoside contains a ribose sugar and base; a nucleotide contains a ribose sugar, base, and phosphoryl groups.
뉴클레오사이드는 리보스당과 염기로 구성되어 있고, 뉴클레오타이드는 여기에 **인산기(phosphoryl group)**가 추가된 것입니다.
✅ 2. In what way was Chargaff's rule an essential part of Watson and Crick's discovery of the double-helical structure of DNA?
Chargaff’s rule that A = T and G = C in DNA molecules led Watson and Crick to focus on base pairing.
샤가프의 규칙(A=T, G≡C)은 왓슨과 크릭이 염기쌍 형성에 주목하도록 하여, DNA의 이중나선 구조를 발견하는 데 중요한 단서를 제공했습니다.
A=T, G≡C라는 규칙 덕분에, 왓슨과 크릭은 염기쌍이 서로 짝을 이룬다는 걸 깨달았습니다 .
그래서 DNA는 예쁜 이중나선 구조를 가진다는 걸 발견할 수 있었습니다
✅ 3. What are the three forms of double-helical DNA? Discuss their similarities and major differences.
3. A-, B-, and Z-form DNA, all of which are antiparallel double helices. The covalent linkages between nucleotides are the same, but conformations differ, most distinctly in width of the helices.
A-form is the widest helix, whereas Z-form is the narrowest.
The number of base pairs per helical turn is greater in A-DNA than in B-DNA.
Z-DNA contains 12 bp per helical turn because even though it is narrow, it is stretched relative to the A- and B-forms.
A- and B-DNA are right-handed helices; Z-DNA is a left-handed helix.
3. A형, B형, Z형 DNA는 모두 이중 나선 구조이며, 두 가닥은 서로 역방향(antiparallel)입니다.
각 DNA에서 뉴클레오타이드 사이의 공유 결합은 같지만, 전체적인 나선의 형태(모양)는 다릅니다.
- A형 DNA는 가장 넓은 나선이고,
- Z형 DNA는 가장 좁은 나선입니다.
또한 나선 한 바퀴를 도는 데 포함되는 염기쌍 수에서도 차이가 있어요:
- A형 DNA는 B형 DNA보다 염기쌍 수가 많고,
- Z형 DNA는 한 바퀴에 12개의 염기쌍을 가지는데, 폭은 좁지만 길게 늘어난 형태이기 때문이에요.
마지막으로 방향성에서도 차이가 있는데:
- **A형과 B형 DNA는 오른손 방향 나선 구조(right-handed helix)**이고,
- **Z형 DNA는 왼손 방향 나선 구조(left-handed helix)**입니다.
[정리]
🌟 DNA의 세 가지 이중나선 형태: A-, B-, Z-form DNA
공통점 (Similarities)
- 모두 이중나선(double helix) 구조 🧬
- 두 가닥은 역방향(antiparallel) 으로 배열 🔁
- 뉴클레오타이드 간 공유 결합 방식은 동일 ⚙️
💎 차이점 (Differences)
| 🧡 A-DNA | 💙 B-DNA | 💚 Z-DNA | |
| 🌪️ 나선 방향 | 오른쪽 (Right-handed) | 오른쪽 (Right-handed) | 왼쪽 (Left-handed) |
| 📏 나선 굵기 | 가장 넓음 | 중간 (표준) | 가장 좁음 |
| 🔄 염기쌍 수 (1회전) | 약 11개 | 약 10.5개 | 12개 |
| 🔬 외형적 특징 | 납작하고 뚱뚱함 | 매끄럽고 균형 잡힘 | 지그재그(Zigzag) 형태 |
| 🌵 주로 나타나는 환경 | 건조한 환경 | 수화 상태(물 많은 상태) | 특정 염기서열, 고이온 환경 |
✅ 8. Why is DNA more stable than RNA in the cell?
The 2’-hydroxyl group of ribose in RNA can lead to autocleavage of the phosphodiester backbone. DNA does not have this 2'-hydroxyl group and is therefore not prone to autocleavage.
RNA의 리보스에는 2'-OH 그룹이 있어 **자가 절단(autocleavage)**이 쉽게 일어나지만, DNA는 이 그룹이 없어서 더 안정적입니다.
[정리]
- RNA는 **리보스(ribose)**라는 당을 가지고 있습니다.
- 이 리보스에는 **2번 탄소(2')에 -OH (하이드록실기)**가 붙어 있습니다! 💧
- 이 2'-OH는 스스로 인산다이에스터 결합을 공격해서 **자가 절단(autocleavage)**을 일으킬 수 있습니다! ⚠️
- 반면, DNA는 2'-OH가 없습니다! (대신 수소, -H만 있음)
👉 그래서 스스로 잘리지 않고 훨씬 안정적입니다 🛡️\
- RNA: 2'-OH 있음 → 자가 절단 가능 → 불안정
- DNA: 2'-OH 없음 → 자가 절단 불가 → 안정적
✅ 15. Describe the difference between intron and exon sequences in eukaryotic genes.
Introns and exons are two types of sequences found in eukaryotic genes. Exons contain the coding sequences, whereas introns contain noncoding sequences.
인트론(introns)과 엑손(exons)은 진핵생물 유전자에서 발견되는 두 가지 유형의 서열입니다.
- 엑손은 단백질을 만드는 데 필요한 '코딩 서열(coding sequences)'을 포함하고 있는 반면,
- 인트론은 단백질로 번역되지 않는 '비암호화(non-coding) 서열'을 포함하고 있습니다.
| 💙 엑손 (Exon) | 💛 인트론 (Intron) | |
| 🧩 하는 일 | 단백질 만드는 설계도 (코딩) | 단백질 만들 때 필요 없는 부분 (비코딩) |
| 🧵 전사 후 | 남아서 단백질로 번역됨 | 스플라이싱(splicing) 때 잘려나감 ✂️ |
| 🎯 기억 꿀팁 | Exon = Expressed (표현됨) | Intron = In between (중간에 있음) |
=> 엑손은 단백질을 만드는 필요한 부분,인트론은 잘라내는 불필요한 부분이에요!
✅ 16. What is plasmid DNA, and what is its function in bacteria?
Plasmids are circular, self-replicating DNA molecules. They confer a survival advantage for bacteria by expressing antibiotic-resistance genes.
플라스미드(plasmid)**는 원형이고 자가복제가 가능한 DNA로, 항생제 저항성 유전자 등을 통해 박테리아 생존에 이점을 제공합니다.
✅ 17. Describe the essential biochemical steps in a PCR cycle.
Denaturation, to separate the DNA strands, annealing, to match up the primers with complementary regions on the template, and primer extension, in which DNA polymerase synthesizes a complementary strand starting from the primer.
DNA 변성(Denaturation): DNA의 두 가닥을 분리하는 단계입니다.
어닐링(Annealing): 프라이머(primer)가 주형(template) DNA의 상보적인 부분과 결합하도록 맞춰주는 단계입니다.
프라이머 연장(Primer extension): DNA 중합효소(DNA polymerase)가 프라이머로부터 시작하여 상보적인 새 DNA 가닥을 합성하는 단계입니다.
✅ 19. Why are dideoxynucleoside triphosphates required for Sanger DNA sequencing?
When dideoxynucleoside triphosphates are incorporated into growing DNA strands, strand synthesis is terminated because they lack a ribose 3′-hydroxyl group. For sequencing, strand synthesis is sequentially stopped at each nucleotide, leading to products that differ in length by one base. The sequence is determined by separating the molecules by size, then reading the order of dideoxynucleoside triphosphates ending each product.
디디옥시뉴클레오사이드 삼인산(dideoxynucleoside triphosphates, ddNTPs)이 성장 중인 DNA 가닥에 삽입되면, 합성이 중단됩니다. 그 이유는 ddNTP에는 **리보스의 3′-하이드록실기(–OH)**가 없기 때문입니다.
염기서열 분석(시퀀싱)에서는, 각 뉴클레오타이드에서 가닥 합성이 차례로 멈추도록 ddNTP가 사용됩니다.
이로 인해 한 염기씩 길이가 다른 DNA 조각들이 만들어지고,
이 조각들을 길이별로 분리한 후, 각각의 끝에 있는 ddNTP를 읽으면 DNA의 염기서열을 알아낼 수 있습니다.
✅ 33. The following table shows where different restriction endonucleases (restriction enzymes) cleave DNA. The abbreviation R represents the purines (adenine and guanine), Y represents the pyrimidines (cytosine, thymine, and uracil), and W represents adenine or thymine.
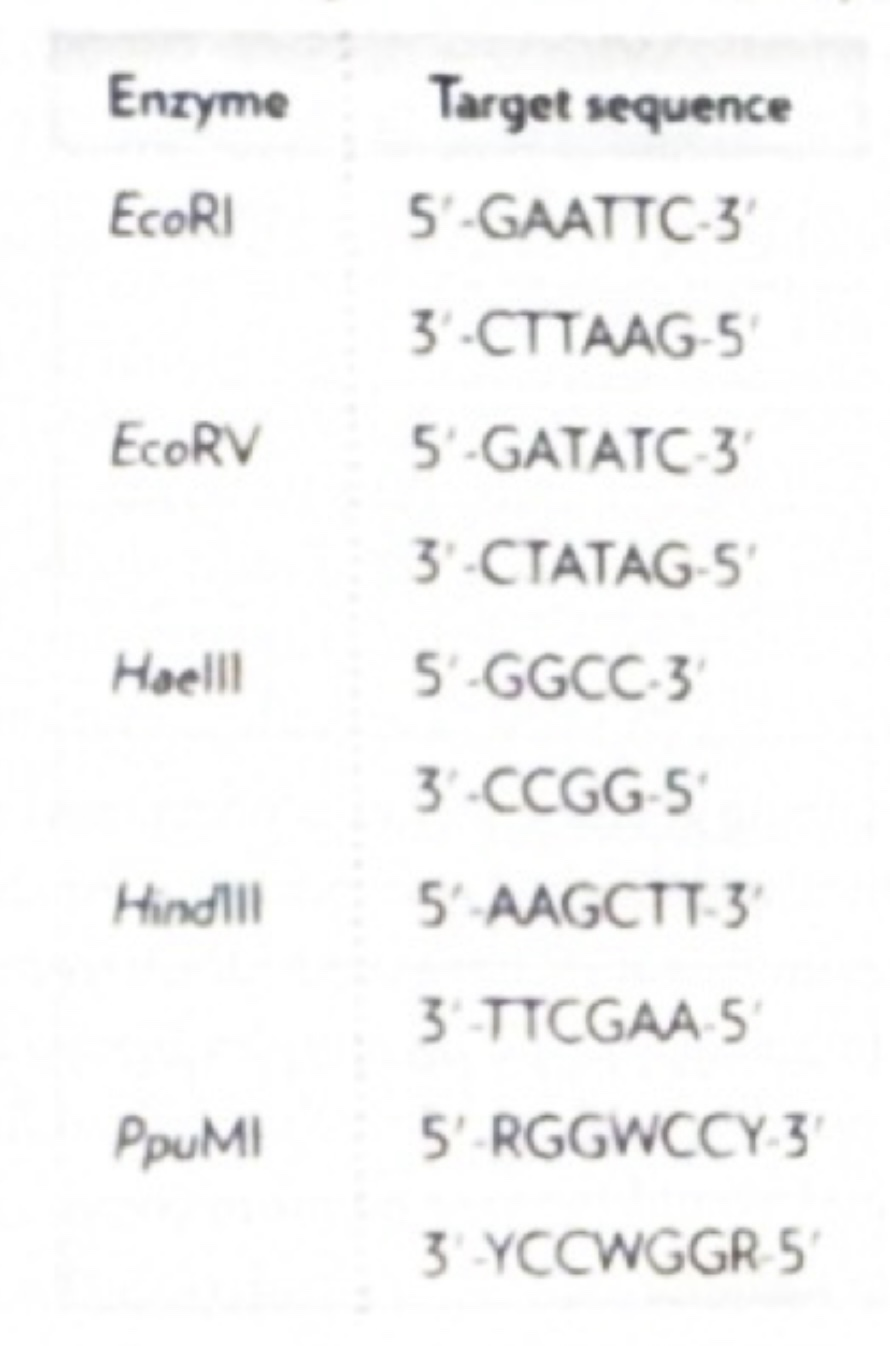
a. Which restriction endonuclease(s) would cleave at the following sequence: GCCAATTGAAGCTT?
👉 정답: HindIII
b. Which restriction endonuclease(s) would cleave at the following sequence: AAAGCTTGTGATATC?
👉 정답: EcoRV
[정리]
제한효소(Restriction enzymes)가 특정 DNA 염기서열을 인식해서 절단(cleave) 하는지 확인하는 문제
🧪 제한효소 요약표
| Enzyme | 인식 서열 (Target Sequence) |
| EcoRI | 5'-GAATTC-3' |
| EcoRV | 5'-GATATC-3' |
| HaeIII | 5'-GGCC-3' |
| HindIII | 5'-AAGCTT-3' |
| PpuMI | 5'-RGGWCCY-3' (R=A/G, Y=C/T/U, W=A/T) |
🌟 (a) GCCAATTGAAGCTT
👉 이 염기서열에서 제한효소가 인식할 수 있는 패턴을 찾아보면…
- 뒤쪽에 **"AAGCTT"**라는 서열이 있음!
- 이건 바로 HindIII의 인식 서열과 정확히 일치해요! 🎯
✅ 정답: HindIII
🌟 (b) AAAGCTTGTGATATC
👉 이 서열에서 눈여겨봐야 할 부분은 "GATATC"
- 맨 끝 쪽에 보면 **"GTGATATC"**가 있고
- 이 안에서 정확히 **"GATATC"**라는 서열이 EcoRV의 인식 서열과 일치해요!
✅ 정답: EcoRV
- 제한효소는 특정한 DNA 조각을 잘라내는 '가위'예요 ✂️
- 문제에서는 주어진 DNA 서열 안에, 어떤 효소의 타깃 서열이 들어 있는지를 찾는 거예요! 🔍
- 들어있으면 그 효소가 해당 서열을 절단할 수 있음! ✔️
✅ 34. Why is it important that plasmids contain antibiotic-resistance genes when they are used for cloning in a laboratory?
When a plasmid is transformed into a culture of bacterial cells, not every cell will take up the plasmid. The use of antibiotic selection prevents bacteria without the plasmid from growing, so a bacterial colony that is antibiotic resistant can be assumed to have taken up the plasmid successfully.
플라스미드를 세균에 넣었을 때, 모든 세포가 이를 받아들이진 않기 때문에
항생제 저항성 유전자가 있는 플라스미드를 사용하면, 플라스미드를 가진 세균만 생존하게 되어 형질전환 여부를 쉽게 구별할 수 있습니다.
[정리]
✅ 34. 왜 클로닝에 사용하는 플라스미드에 항생제 저항성 유전자가 있어야 할까? 💊🦠
플라스미드를 세균에 넣어도 👉 모든 세포가 플라스미드를 받는 건 아닙니다
그래서 누가 진짜 플라스미드를 가진 건지 구분이 필요합니다 🔍
🧪 항생제 저항성 유전자의 역할은?
| 상황 | 설명 |
| ✅ 플라스미드를 가진 세균 | 항생제 저항성이 생겨서 살아남아요 🛡️ |
| ❌ 플라스미드 없는 세균 | 항생제에 죽어요 💀 |
➡ 결과적으로 살아 있는 세균만 골라낼 수 있어요!
👉 이게 바로 형질전환 성공 세균이에요! 🎯
항생제 저항성 유전자는
👉 플라스미드를 가진 세균만 살아남게 만드는 필터 같은 역할을 해요!
그래서 실험실에서 형질전환이 잘 되었는지 확인하기 쉽게 해주는 도구예요
[CH4]
✅ Review Question 2
Q:
Explain how the pKₐ of an amino acid can differ within a folded protein compared to that of the free amino acid in water.
❓ 해석:
접힌 단백질 내에서 아미노산의 pKₐ가, 물속의 자유로운 상태일 때의 pKₐ와 어떻게 다를 수 있는지 설명하시오.
A:
Chemical properties of nearby functional groups can alter the pKₐ of specific amino acid side chains if it is energetically favorable. For example, because positive or negative charges in the hydrophobic interior are energetically unfavorable, the pKₐ value of a side chain may be altered to favor the neutral state over the charged state at physiological pH.
✅ 해석:
주변 작용기의 화학적 성질은, 에너지적으로 유리할 경우 특정 아미노산 곁사슬의 pKₐ를 변화시킬 수 있음.
예를 들어, 소수성 내부에서 양전하 또는 음전하는 에너지적으로 불안정하므로, 곁사슬의 pKₐ는 생리적 pH에서 전하 상태보다 중성 상태를 선호하도록 바뀔 수 있음.
🧠 정말 쉽게 설명 및 정리:
단백질이 접히면 아미노산이 내부에 묻히게 됨.
단백질 내부는 물을 싫어하는 소수성 환경이므로 전하를 띠는 상태는 불안정해짐.
그래서 주변 환경이 전하를 띠지 않는 쪽이 안정적이라면, pKₐ가 바뀌어 중성 상태가 더 잘 유지되도록 함.
👉 즉, 접힌 구조 안에서는 아미노산이 전하를 없애는 방향으로 성질(pKₐ)을 조정함.
✅ Review Question 7
Q:
Explain how an α helix can be amphipathic.
❓ 해석:
α-헬릭스가 어떻게 양친매성을 가질 수 있는지 설명하시오.
A:
α helices are amphipathic when residues that are hydrophobic (or hydrophilic) are placed three to four amino acids away from each other. Because there are 3.6 amino acids per turn, amino acids that are three to four residues apart will lie on the same side of the helix.
✅ 해석:
α-헬릭스는 소수성(또는 친수성)인 잔기들이 서로 3~4개의 아미노산 간격으로 배치될 때 양친매성을 가짐.
헬릭스는 한 바퀴에 3.6개의 아미노산으로 구성되므로, 3~4개 간격으로 떨어진 잔기들은 헬릭스의 같은 면에 위치하게 됨.
🧠 정말 쉽게 설명 및 정리:
α-헬릭스는 아미노산이 나선형으로 감긴 구조를 가짐.
한 바퀴에 약 3.6개의 아미노산이 들어감 → 따라서 3~4칸 간격으로 배치된 아미노산들은 같은 면에 모이게 됨.
이때 소수성 잔기들이 한쪽 면, 친수성 잔기들이 다른 면에 배열되면,
한쪽은 물과 잘 어울리고, 다른 쪽은 기름과 잘 어울리는 양친매성 구조가 됨.
👉 즉, 아미노산 잔기들이 규칙적으로 배열되면서 양쪽 성질을 동시에 갖는 헬릭스가 만들어짐.
✅ Review Question 10
Q:
What are three ways in which quaternary structures can provide increased functionality for a protein?
❓ 해석:
단백질의 4차 구조가 단백질의 기능을 향상시킬 수 있는 세 가지 방법은 무엇인가?
A:
Complexes can provide structural properties not present in individual subunits and can be a mechanism for regulation of protein function through conformational changes affecting subunit interfaces. Also, bringing functional components into proximity can increase efficiency of biochemical processes.
✅ 해석:
복합체는 개별 단위체에는 없는 구조적 특성을 제공할 수 있음.
또한, 단위체 간의 상호작용 면에서 일어나는 입체 구조 변화를 통해 단백질 기능 조절의 메커니즘이 될 수 있음.
게다가 기능적 요소들을 서로 가까이 위치시킴으로써, 생화학적 과정의 효율을 높일 수 있음.
🧠 정말 쉽게 설명 및 정리:
여러 단백질 조각(=소단위체)이 모여서 만든 4차 구조는,
1️⃣ 혼자서는 못하는 특별한 구조를 만들어냄.
2️⃣ 모양 변화를 통해 기능이 켜지거나 꺼지도록 조절 가능함.
3️⃣ 효소나 반응 부위들이 가까이 모이게 되어 반응이 더 빠르고 효율적으로 일어남.
👉 즉, 여럿이 뭉쳐서 더 잘 작동하는 팀플레이 구조가 만들어짐.
✅ Review Question 13
Q:
Name and briefly describe the three proposed mechanisms of how globular proteins fold in aqueous environments.
❓ 해석:
구형 단백질이 수용액 환경에서 접히는 것으로 제안된 세 가지 메커니즘의 이름을 말하고, 간단히 설명하시오.
A:
(1) Hydrophobic collapse model: Hydrophobic residues form the interior of the protein because of the hydrophobic effect, causing a loosely defined tertiary structure called a molten globule. Then, proximal residues in the molten globule interact to form well-ordered secondary and tertiary structures through van der Waals interactions and hydrogen bonding.
(2) Framework model: Initially, local secondary structures form independently. Then, local secondary structures interact to form tertiary structures.
(3) Nucleation model: Random interactions lead to a localized region of correct three-dimensional structure, which facilitates the formation of the surrounding tertiary and secondary structures.
✅ 해석:
(1) 소수성 붕괴 모델: 소수성 잔기들이 소수성 효과에 의해 단백질의 내부로 모여듦 → 이로 인해 **몰튼 글로불(molten globule)**이라 불리는 느슨한 삼차 구조가 형성됨. 이후, 가까운 잔기들끼리 반데르발스 힘과 수소 결합을 통해 잘 정돈된 2차 및 3차 구조를 형성함.
(2) 프레임워크 모델: 처음에는 국소적인 이차 구조가 독립적으로 형성됨. 이후, 이 구조들이 서로 상호작용하여 삼차 구조를 이룸.
(3) 뉴클리에이션 모델: 무작위적인 상호작용을 통해 국소적인 올바른 3차원 구조가 먼저 형성되고,
그 부위를 기반으로 주변의 2차 및 3차 구조가 접힘.
🧠 정말 쉽게 설명 및 정리:
단백질이 접히는 방식은 여러 가지로 제안됨:
1️⃣ 소수성 붕괴 모델:
소수성 아미노산이 안쪽으로 몰려들면서 뭉침 → 중간 구조(몰튼 글로불) 형성됨 → 그 안에서 정확한 구조로 정리됨.
2️⃣ 프레임워크 모델:
처음에 알파헬릭스나 베타시트 같은 구조들이 따로따로 만들어짐 → 그 구조들이 서로 연결되며 전체 모양 완성됨.
3️⃣ 뉴클리에이션 모델:
어쩌다 보니 일부에서 제대로 된 구조가 먼저 생김 → 그 주변으로 다른 구조들도 따라가며 접힘.
👉 핵심은 접히는 방식이 전체가 먼저냐, 부분이 먼저냐, 중간 뭉침이 있느냐에 따라 나뉨.
✅ Challenge Problem 15
Q:
Consider a pentapeptide with the sequence Lys–Tyr–Glu–Asn–His (that is, K–Y–E–N–H). Using the pKₐ values in Table 4.3, make a table to show the approximate charges (if any) on the terminal groups and the side chain of each residue in the peptide at pH 7 and at pH 11. What would be the approximate net charge on this pentapeptide at pH 7 and at pH 11?
❓ 해석:
Lys–Tyr–Glu–Asn–His (즉, K–Y–E–N–H)로 이루어진 펜타펩타이드를 고려하시오.
표 4.3의 pKₐ 값을 이용하여, pH 7과 pH 11에서 말단 그룹들과 각 아미노산 잔기의 곁사슬이 띠는 전하(있다면)를 표로 나타내시오.
또한 pH 7과 pH 11에서 이 펩타펩타이드의 전체 전하를 추정하시오.
A:
| Functional group | Charge at pH 7 | Charge at pH 11 |
| N-terminal amino group | +1 | 0 |
| C-terminal carboxyl group | –1 | –1 |
| Side chain of Lys | +1 | 0 |
| Side chain of Tyr | 0 | –1 |
| Side chain of Glu | –1 | –1 |
| Side chain of Asn | 0 | 0 |
| Side chain of His | 0 | 0 |
| Net charge | 0 | –3 |
✅ 해석:
| 기능성 그룹 | pH 7의 전하 | pH 11의 전하 |
| N-말단 아미노기 | +1 | 0 |
| C-말단 카복실기 | –1 | –1 |
| Lys 곁사슬 | +1 | 0 |
| Tyr 곁사슬 | 0 | –1 |
| Glu 곁사슬 | –1 | –1 |
| Asn 곁사슬 | 0 | 0 |
| His 곁사슬 | 0 | 0 |
| 총 전하 | 0 | –3 |
🧠 정말 쉽게 설명 및 정리:
펩타펩타이드 K–Y–E–N–H의 전하 상태는 pH에 따라 다르게 변함.
pH 7일 때:
- +1 (N말단)
- –1 (C말단)
- +1 (Lys 곁사슬)
- –1 (Glu 곁사슬)
→ 나머지는 전하 없음
→ 전체 전하 = 0
pH 11일 때:
- 아민기와 Lys는 전하를 잃고
- Tyr는 새로운 –1 전하를 가짐
→ 전체 전하 = –3
👉 pH가 올라가면 양전하는 사라지고, 음전하는 유지되거나 생김.
→ 따라서 pH 11에서는 펩타펩타이드가 음전하를 띠게 됨.
✅ Challenge Problem 17
Q:
In the closely packed interior of the tertiary structure of an enzyme, an alanine residue was changed by mutation to a valine, leading to a loss of enzyme activity, even though that residue was not directly involved in the catalytic function of the enzyme. Activity was partially regained, however, when an additional mutation at a different position in the primary structure changed an isoleucine residue to a glycine. On the basis of the structure of the amino acid side chains of alanine, valine, isoleucine, and glycine, explain how the first mutation (that is, Ala→Val) likely caused a loss of activity, whereas the second mutation (that is, Ile→Gly) in another region of the protein resulted in a partial recovery of enzyme activity.
❓ 해석:
효소의 삼차 구조 내 빽빽한 내부에서, 알라닌 잔기가 발린으로 돌연변이 되면서 효소 활성이 감소함.
이 잔기는 촉매 기능에 직접 관여하지 않음에도 불구하고 이러한 일이 발생함.
그러나 이후, 1차 구조 내 다른 위치의 아이소류신 잔기가 글라이신으로 바뀌자 활성이 부분적으로 회복됨.
알라닌, 발린, 아이소류신, 글라이신의 곁사슬 구조를 바탕으로,
첫 번째 돌연변이(Ala→Val)가 왜 활성을 잃게 만들었는지,
그리고 두 번째 돌연변이(Ile→Gly)가 왜 부분적으로 활성을 회복시켰는지 설명하시오.
A:
Changing an Ala to a Val would introduce a bulkier side chain, taking up more volume in the protein interior; the resulting structural adjustments in the tertiary structure must be serious enough to cause the enzyme to lose activity. The replacement of an Ile residue with a Gly allows a tertiary structure close enough to the original structure for partial enzyme activity.
✅ 해석:
Ala를 Val로 바꾸면 더 부피가 큰 곁사슬이 생기게 되어 단백질 내부의 공간을 더 많이 차지하게 됨.
그로 인해 단백질 삼차 구조에 생긴 변화가 효소 활성을 잃을 정도로 심각했을 것임.
하지만 Ile을 Gly로 바꾸면, 보다 작은 곁사슬이 생기게 되어,
원래 구조와 비슷한 삼차 구조가 형성될 수 있게 되고,
그 결과 효소 활성이 부분적으로 회복됨.
🧠 정말 쉽게 설명 및 정리:
처음 돌연변이 (Ala → Val):
- 발린은 알라닌보다 곁사슬이 큼 → 단백질 내부에서 공간을 너무 차지함
- 그로 인해 구조가 비틀리면서 활성을 잃게 됨
두 번째 돌연변이 (Ile → Gly):
- 글라이신은 곁사슬이 거의 없음 → 공간 확보와 유연성 증가됨
- 덕분에 전체 구조가 다시 안정되며, 일부 활성이 돌아옴
👉 핵심은 곁사슬의 크기 차이와 단백질 내부의 공간 구조 변화
→ 하나는 방해했고, 하나는 보정함
✅ Challenge Problem 19
Q:
Using three-letter abbreviations, name the amino acid residues in the following partial protein sequence:
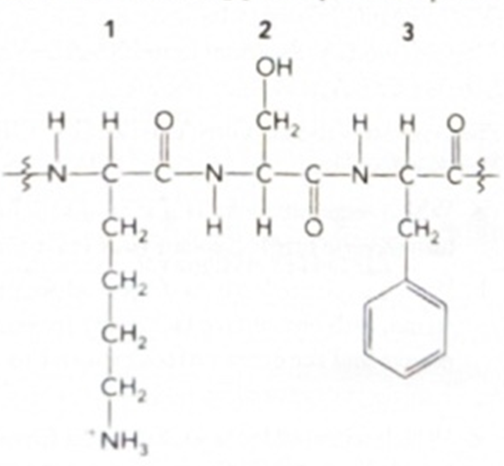
If this region of the protein were part of an α helix, identify one atom or group that would participate as a hydrogen-bond donor to stabilize the structure of the α helix, and label it “Donor.” Then, identify the one atom or group that would participate as a hydrogen-bond acceptor, and label it “Acceptor.”
❓ 해석:
아래에 제시된 단백질 서열에서 아미노산들을 세 글자 약어로 쓰시오.
이 부위가 α-헬릭스의 일부라고 가정했을 때, **수소 결합의 제공자(donor)**로 작용하는 원자 또는 작용기를 하나 고르고 “Donor”로 표시하시오.
그리고 **수소 결합의 수용자(acceptor)**로 작용하는 원자 또는 작용기를 하나 고르고 “Acceptor”로 표시하시오.
A:
- Residues: Lys–Ser–Phe
- Donor: NH of Lys
- Acceptor: C=O of Ser
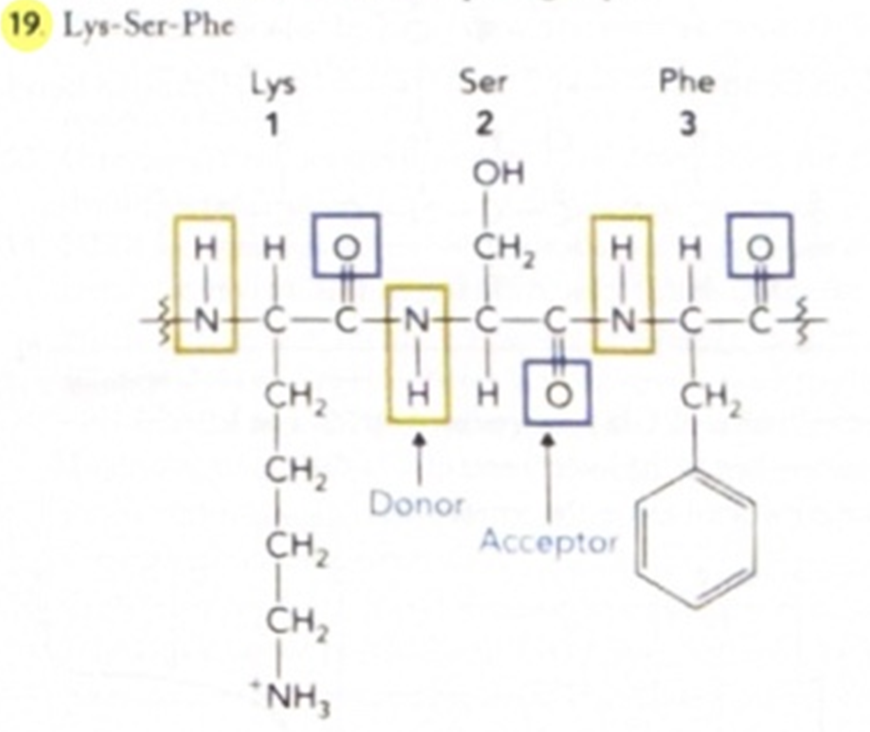
✅ 해석:
아미노산 잔기: Lys–Ser–Phe
수소 결합 제공자(Donor): Lys의 NH (아민기)
수소 결합 수용자(Acceptor): Ser의 C=O (카보닐기)
🧠 정말 쉽게 설명 및 정리:
주어진 서열은 Lys–Ser–Phe이며,
이 서열이 α-헬릭스에 있다면 다음과 같은 수소결합이 형성됨:
- 수소 결합 제공자(Donor): Lys 잔기의 NH 그룹이 수소를 제공함
- 수소 결합 수용자(Acceptor): Ser 잔기의 C=O 그룹이 수소를 받아 결합을 형성함
👉 α-헬릭스에서는 4개 간격의 아미노산 사이에 수소 결합이 생김,
이때 NH는 주고, C=O는 받는 역할을 함.
✅ Challenge Problem 24
Q:
The ionization of the amino acid Glu is characterized by three weak acid groups with pKₐ₁ = 2.1, pKₐ₂ = 4.1, and pKₐ₃ = 9.9. The following illustration shows four possible ionic forms of Glu (a–d) that might occur in solution and a titration curve for Glu.
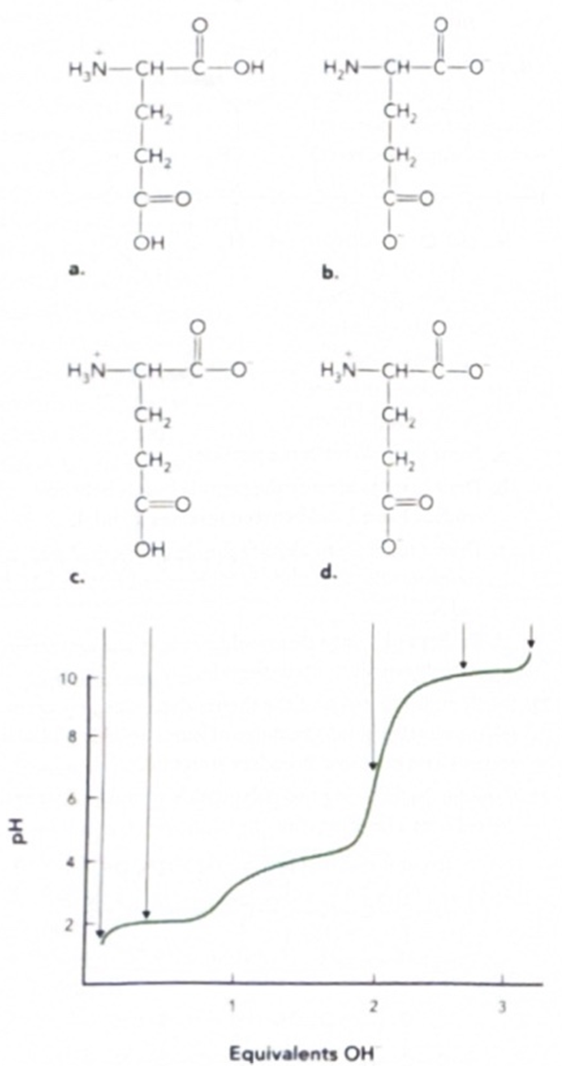
Which of these ionic forms represents the zwitterion of Glu? Identify the structure (by letter) that corresponds to the ionic form of Glu that predominates at each pH value indicated by the arrows. If two ionic forms are present equally, select two choices.
❓ 해석:
아미노산 Glu의 이온화는 pKₐ₁ = 2.1, pKₐ₂ = 4.1, pKₐ₃ = 9.9인 세 개의 약산성 작용기에 의해 특징지어짐.
아래 그림에는 용액에서 나타날 수 있는 Glu의 네 가지 이온 형태(a–d)와 해당 아미노산의 적정 곡선이 나와 있음.
이 중 어떤 이온형이 Glu의 **zwitterion(쌍극이온)**을 나타내는지 고르시오.
또한, 화살표가 가리키는 pH 값에서 **주로 존재하는 이온 형태(문자 선택)**를 고르시오.
(두 가지 형태가 동등하게 존재할 경우, 두 개 선택할 것)
A:
The zwitterion of Glu is represented by (c).
The letter(s) corresponding to the ionic forms of Glu that occur at each pH value are written above the arrows:
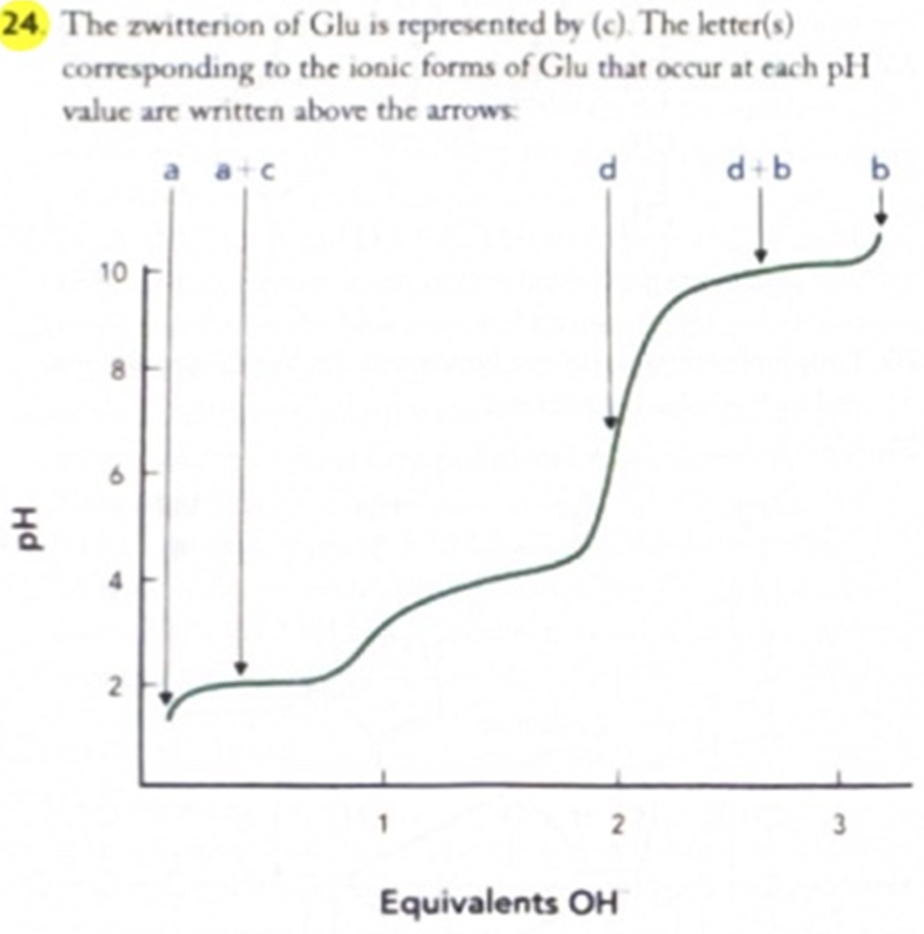
✅ 해석:
Glu의 **zwitterion(쌍극이온)**은 (c)로 나타남.
각 pH 값에서 Glu의 이온형을 나타내는 문자들은 화살표 위에 표시된 그대로 해당됨.
🧠 정말 쉽게 설명 및 정리:
Glu는 다음과 같이 3개의 이온화 가능한 부분을 가짐:
- α-COOH (pKₐ ≈ 2.1)
- 곁사슬 COOH (pKₐ ≈ 4.1)
- α-NH₃⁺ (pKₐ ≈ 9.9)
zwitterion이란, 한 분자 내에 양전하(+)와 음전하(–)가 모두 존재하지만, 전체 전하는 0인 상태를 말함.
→ Glu의 경우, 아미노기가 +1, 카복실기 2개가 –1씩 합쳐서 0이 되는 상태가 zwitterion임
→ 이 상태는 그림에서 **(c)**로 표현됨.
각 pH에서는 다음과 같은 형태가 주로 존재함 (정답은 그림 화살표 위에 해당하는 문자):
- 낮은 pH (1 이하): 모든 작용기 프로톤화됨 → +1 상태
- 중간 pH (
36): zwitterion 형태(c) - 높은 pH (>10): 아미노기도 탈양성자화되어 전체 –1 또는 –2 상태
👉 핵심은 pH가 올라갈수록 양전하가 줄고 음전하가 늘어남
→ 쌍극이온은 중간 pH에서 주로 존재함.
'생화학 > 대학 강의' 카테고리의 다른 글
| 생화학 중간 정리 final (0) | 2025.04.24 |
|---|---|
| 생화학 중간 정리 (1) | 2025.04.23 |
| 생화학 중간고사 정리 (0) | 2025.04.14 |
| 생화학 대학 강의 정리 (0) | 2025.03.20 |